John Dalton: Durante el S.XVIII y principios del S.XIX algunos científicos habían investigado distintos aspectos de las reacciones químicas, obteniendo las llamadas leyes clásicas de la Química.
J.J. Thomson: Demostró que dentro de los átomos hay unas partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones. De este descubrimiento dedujo que el átomo debía de ser una esfera de materia cargada positivamente, y en su interior estaban incrustados los electrones.
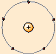 E. Rutherford: Demostró que los átomos no eran macizos sino que están mayormente vacíos y en su centro hay un diminuto núcleo. Dedujo que el átomo estaba formado por una corteza con los electrones girando alrededor del núcleo central cargado positivamente.
E. Rutherford: Demostró que los átomos no eran macizos sino que están mayormente vacíos y en su centro hay un diminuto núcleo. Dedujo que el átomo estaba formado por una corteza con los electrones girando alrededor del núcleo central cargado positivamente. Niels Bohr: Descubrió los espectros atómicos discontinuos originados por la radiación emitida por los átomos excitados de los elementos en estado gaseoso. Propuso un nuevo modelo atómico, en el cual los electrones giran alrededor del núcleo en unos niveles bien definidos.
Niels Bohr: Descubrió los espectros atómicos discontinuos originados por la radiación emitida por los átomos excitados de los elementos en estado gaseoso. Propuso un nuevo modelo atómico, en el cual los electrones giran alrededor del núcleo en unos niveles bien definidos. Schrödinger y Heisenberg: Es un modelo de gran complejidad matemática, tanta que usándolo sólo se puede resolver con exactitud el átomo de hidrógeno. Para resolver átomos distintos al de hidrógeno se recurre a métodos aproximados. No se habla de órbitas, sino de orbitales. Un orbital es una región del espacio en la que la probabilidad de encontrar al electrón es máxima. Los orbitales atómicos tienen distintas formas geométricas.
Schrödinger y Heisenberg: Es un modelo de gran complejidad matemática, tanta que usándolo sólo se puede resolver con exactitud el átomo de hidrógeno. Para resolver átomos distintos al de hidrógeno se recurre a métodos aproximados. No se habla de órbitas, sino de orbitales. Un orbital es una región del espacio en la que la probabilidad de encontrar al electrón es máxima. Los orbitales atómicos tienen distintas formas geométricas.

No hay comentarios:
Publicar un comentario